Uso do PRP e Célula Tronco no Tratamento Osteoartrose Joelho
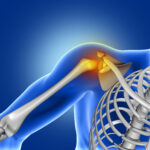
O quadro degenerativo ao nivel das articulações é tema cada vez mais debatido em todo o mundo. Tal quadro quando acomete a articulacao do joelho recebe o nome de genoartrose e acomete tanto homens quanto mulheres, sendo mais prevalente acima de 60 anos. Esta evoluiu de maneira variável mas sempre com grande impacto funcional e na qualidade de vida dos pacientes. Diversas são as modalidades de tratamento, desde o tratamento conservador, ate o tratamento cirurgico. Dentre as modalidades conservadoras temos os medicamentos, as fisioterapias e o controle de peso, medidas que comprovadamente tem impacto no controle do quadro degenerativo. Outras, embora sejam promissoras, ainda não são liberadas e ou não tem a devida comprovação científica. O uso do plasma rico em plaquetas (PRP) e as células tronco não são alternativas liberadas para utilizacao, embora sejam utilizadas de modo irrestrito por alguns profissionais. São liberadas apenas para pesquisas e não devem ser utilizadas como método de tratamento. Logo, antes de se submeter a qualquer tratamento consulte bom profissional e que seja ligado a um grande centro.
O setor de Ortopedia do Hospital Madre Teresa possui uma equipe preparada para realizar atendimentos 24 horas por dia e contando com equipamentos de suporte de alta qualidade. Estamos localizados na Av. Raja Gabáglia, 1002, no bairro Gutierrez em Belo Horizonte.
Resposta da ANVISA ao questionamento da SBCJ
Resposta da ANVISA ao questionamento da SBCJ sobre os tratamentos com PRP e utilização de célulastronco para uso em ortopedia:
“Em resposta ao seu questionamento, informamos que a produção e uso do PRP no âmbito da Hemoterapia, deve seguir o preconizado pela legislação vigente para a área de sangue (RDC da Anvisa nº 57/2010, que determina o regulamento sanitário para os serviços que desenvolvem atividades relacionadas ao ciclo produtivo do sangue humano e componentes e procedimentos transfusionais e a Portaria Ministerial nº 1353/2011, que aprova o regulamento Técnico de Procedimentos Hemoterápicos). O PRP, também conhecido como gel plaquetário ou gel de plaquetas, produzido e utilizado em serviços de hemoterapia, é obtido por meio de doação altruísta e voluntária, com centrifugação do sangue total e separação do concentrado de hemácias e o PRP. O PRP é então submetido a uma nova centrifugação para a separação do concentrado de plaquetas e do plasma, sendo, portanto um produto intermediário na produção de outros hemocomponentes.
O PRP tem sido utilizado em procedimentos de Ortopedia, Cirurgia, Dermatologia e Odontologia, cujas indicações clínicas e terapêuticas devem ser determinadas pelo Conselho Federal de Medicina e o de Odontologia. Segundo Parecer nº. 20/2011 do Conselho Federal de Medicina (CFM), datado de 12 de julho de 2011, o uso do PRP em procedimentos não hemoterápicos é considerado experimental, sem comprovado grau de utilidade e definitivo uso dentro da prática terapêutica com evidências científicas robustas. O referido Parecer nº. 20/2011 destaca também que há resultados diversos, discrepantes, no uso do PRP, reforçando-se o caráter ainda experimental e a necessidade de pesquisas científicas sobre o assunto. A Resolução CFM nº 1.499, 26 de agosto de 1998, proíbe aos médicos a prestação de serviços de práticas terapêuticas não reconhecidas pela comunidade científica. A referida Resolução proíbe também qualquer vinculação de médicos a anúncios referentes a métodos e práticas sem comprovação científica. O reconhecimento científico, quando e se ocorrer, ensejará Resolução do CFM oficializando sua prática pelos médicos no país.
Dessa forma, como se trata de um procedimento experimental, o uso de PRP em procedimentos não hemoterápicos, não está regulamentado por esta Anvisa.
Com relação à utilização de células-tronco para uso em ortopedia, informamos que a Anvisa publicou a Resolução de Diretoria Colegiada – RDC n.°9, que dispõe sobre os Centros de Tecnologia Celular (CTC) para fins de pesquisa clínica e terapia. Essa resolução tem por objetivo: Art. 2° … estabelecer requisitos técnico-sanitários mínimos para a coleta, processamento, acondicionamento, armazenamento, testes de controle de qualidade, descarte, liberação para uso e transporte de células humanas e seus derivados visando à segurança e qualidade das células e seus derivados disponibilizados para pesquisa clínica e terapia. Portanto, as células que serão utilizadas em um ensaio clínico ou terapia devem ser manipuladas em um CTC com licença de funcionamento emitida pela vigilância sanitária local. A RDC n.°9/2011, estabelece ainda que: Art. 7° Células humanas e seus derivados só poderão ser disponibilizados para pesquisa clínica e/ou terapia pelos CTCs, mediante a comprovação de aprovação da pesquisa clínica pelo sistema CEP/CONEP ou comprovação de que o procedimento terapêutico é autorizado pelo Conselho Federal de Medicina (CFM) ou Conselho Federal de Odontologia (CFO). Sendo assim, informamos que a “aprovação” de tratamentos/terapias que utilizem células-tronco não é regulada pela Anvisa no momento. O Conselho Federal de Medicina – CFM possui duas Resoluções, a Resolução CFM 1499/98 (http://www.portalmedico.org.br/resolucoes/CFM/1998/1499_1998.htm) e a Resolução CFM 1609/2000 (http://www.portalmedico.org.br/resolucoes/CFM/2000/1609_2000.htm) que versam de maneira geral sobre procedimentos terapêuticos em território nacional, determinando que estes devem ser aprovados pelo CFM para serem considerados válidos e utilizáveis na prática médica nacional. Porém, ainda não houve manifestação do CFM sobre quaisquer práticas terapêuticas que utilize células-tronco humanas, excetuando-se o transplante convencional de células progenitoras hematopoéticas (transplante de medula óssea).
Gostaríamos ainda de informar que a Anvisa instituiu a Câmara Técnica em Terapias Celulares – CAT, uma instância colegiada, de caráter consultivo que tem por finalidade assessorar a Anvisa na área de terapias celulares, incluindo as pesquisa clínicas. A CAT tem membros representantes do CFM, CFO, CONEP, Ministério da Saúde, Associação Brasileira de Terapia Celular – ABTCEL, Sociedade Brasileira de Pesquisa Clínica – SBPC, associações de pacientes e clínicos e epidemiologistas com expertise na área. A proposta de trabalho para esse ano, é que a CAT ajude a elaborar os requisitos regulatórios para anuência prévia da Anvisa para a realização de ensaios clínicos envolvendo células humanas e seus derivados, tendo em vista a avaliação de segurança e eficácia, como já é feito para medicamentos novos”.
Atenciosamente,
ANVISA Atende Central de Atendimento Agência Nacional de Vigilância Sanitária